Neben einer Reihe von regenerativen Therapieansätzen mit dem Ziel, abgestorbene Zellen nach einem Gewebeschaden des Myokards durch neue Kardiomyozyten zu ersetzten, ist ein weiteres wichtiges Konzept, die Toleranz der Zellen gegenüber Stress zu erhöhen und somit den Zelltod von vornherein zu unterbinden. Um derartige kardioprotektive Strategien verfolgen zu können, ist zunächst ein genaues Verständnis der molekularen Mechanismen nötig, die für die Stressantwort, den Zelltod und das Überleben von Kardiomyozyten verantwortlich sind. In dieser Hinsicht geht man generell davon aus, das embryonale und fetale Kardiomyoyzten deutlich resistenter gegenüber pathologischen Bedingungen sind als adulte Zellen.
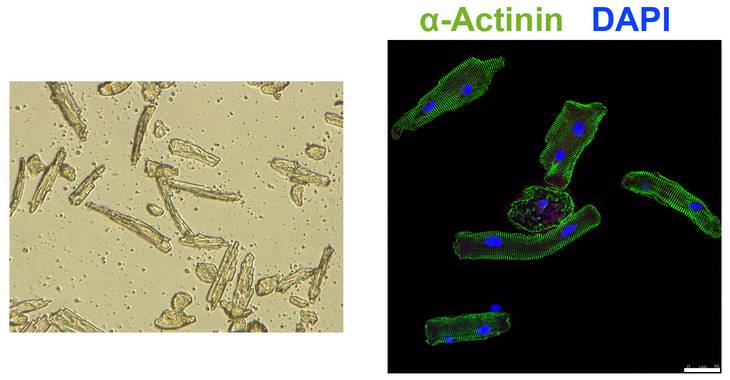
Bei der Untersuchung der embryonalen Herzregeneration in cHccs+/- Mäusen (siehe Projekt 1) fiel auf, dass speziell in HCCS-defizienten und damit defekten Kardiomyozyten verschiedene Gene und Signalkaskaden induziert bzw. aktiviert sind, die bei der zellulären Stressantwort und Zellprotektion eine Rolle spielen. Dies schließt molekulare Mechanismen zur Entgiftung von Sauerstoffradikalen, Regulation des programmierten Zelltods (Apoptose) bzw. des Zellüberlebens sowie Aufrechterhaltung einer normalen Proteinbiosynthese ein. Um herauszufinden, ob eine derartige Stressantwort für das embryonale Herz charakteristisch ist, untersuchten wir adulte Mäuse mit einer mitochondrialen Dysfunktion. In der Tat kann eine Reihe von protektiven Mechanismen im adulte Herzen im Gegensatz zum Embryo nicht aktiviert werden. Derartige Daten unterstützen die Hypothese, dass der Verlust von embryonalen Schutzmechanismen nach der Geburt zu einer hohen Anfälligkeit von adulten Kardiomyozyten gegenüber pathologischen Bedingungen beiträgt. In laufenden Studien untersuchen wir die grundlegenden Unterschiede in der zellulären Stressantwort, der Apoptose-Regulation und des Zellüberlebens in pränatalen im Vergleich zu adulten Kardiomyozyten in vitro. Hierfür werden embryonale, neonatale und adulte Kardiomyozyten sowie stabile kardiale Zelllinien in Anwesenheit verschiedener Inhibitoren der mitochondrialen Atmungskette kultiviert. Die molekularen Veränderungen werden dabei mit Hilfe von RNA-Expressionsanalysen, Western Blot und Immunfluoreszenz-Analysen untersucht. Von besonderem Interesse sind dabei Gene oder Signalkaskaden, die in embryonalen aber nicht in adulten Kardiomyozyten als Antwort auf eine mitochondriale Dysfunktion aktiviert werden, da diese mögliche Ziele darstellen, um das Überleben in Letzteren zu verbessern. Für die vielversprechendsten Kandidaten werden demnach funktionelle Untersuchungen durchgeführt, indem sie in embryonalen Kardiomyozyten gezielt ausgeschaltet werden, was deren Überleben unter Stress reduzieren müsste. In einem entgegengesetzten Ansatz würde die Aktivierung dieser Faktoren in adulten Kardiomyozyten deren Stressresistenz und Überleben erhöhen. Zusammenfassend könnte das embryonale Herz auf diese Weise nicht nur Hinweise für regenerative Therapien im adulten Herzen liefern, sondern auch neue Strategien für zellprotektive Ansätze aufzeigen.