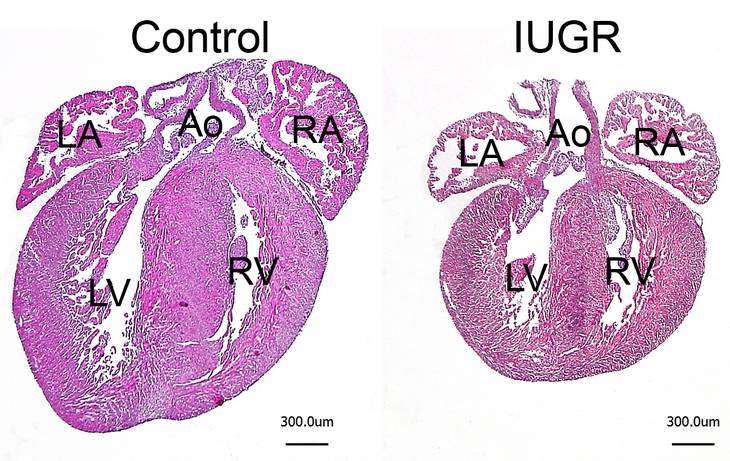
Verschiedene chronische Erkrankungen im Erwachsenenalter, wie beispielsweise die Koronare Herzerkrankung, Bluthochdruck oder Diabetes mellitus, scheinen ihren Ursprung zumindest teilweise in einer gestörten intrauterinen Entwicklung zu haben. Dieses auch „Fetal Programming“ genannte Phänomen prädisponiert betroffene Patienten bereits pränatal für derartige Erkrankungen, so dass diese in Abhängigkeit von zusätzlichen postnatalen Risiko-Faktoren (z.B. Ernährung, Rauchen, Fettleibigkeit) mit größerer Wahrscheinlichkeit zum Ausbruch kommen. In verschiedenen Tiermodellen konnte gezeigt werden, dass eine intrauterine Wachstumsverzögerung im Herzen meist zu einer Reduktion der Kardiomyozytenzahl bei der Geburt führt. Eine derartige Hypoplasie des Herzens konnten wir auch in neugeborenen cHccs+/- Weibchen (siehe Projekt 1) zeigen, wobei sich die Herzgröße in den ersten Wochen nach der Geburt durch ein verstärktes Größenwachstum der Kardiomyozyten normalisiert. Diese kompensatorische Hypertrophie kann jedoch nicht ein Leben lang aufrechterhalten werden, so dass sich die Herzgröße im Alter wieder reduziert. Weiterhin zeigen Herzen nach einer gestörten intrauterinen Entwicklung sowohl auf zellulärer als auch molekularer Ebene eine deutlich veränderte Antwort auf eine kardiale Belastung, was sich vor allem in einer überschießenden Größenzunahme der Kardiomyozyten äußert. Wenn diese veränderte Stressantwort unterdrückt wird, dann führt das zu einer reduzierten Herzleistung in den betroffenen Mäusen. Diese Daten bestätigen, dass eine gestörte intrauterine Entwicklung das Wachstum und die Stressreaktion des erwachsenen Herzens verändern und legt nahe, dass „Fetal Programming“ im Herzen unmittelbar mit kompensatorischen Wachstumsprozessen und der Organgrößenkontrolle verbunden ist.
Wir untersuchen derzeit die Konsequenzen von verschieden intrauterinen Entwicklungsstörungen für das Wachstum und die Stressantwort des postnatalen Herzens. Ein besonderer Fokus liegt dabei auf der mTOR Signalkaskade (mechanistic target of rapamycin), einem wichtigen Regulator von Proteinbiosynthese und Zellwachstum. Während mTOR im Rahmen der pathologischen Hypertrophie im adulten Herzen weitreichend untersucht wurde, ist über seine Rolle im embryonalen oder fetalen Herzen kaum etwas bekannt. Wir haben daher ein Behandlungsprotokoll mit dem mTOR Inhibitor Rapamycin während der späten Fetalphase entwickelt, das eine Wachstumsverlangsamung bis zur Geburt induziert. Mit Hilfe dieses neuen Models untersuchen wir sowohl die Rolle von mTOR während der späten Herzentwicklung als auch die Anpassungsvorgänge im postnatalen Herzen nach einer Rapamycin-induzierten Wachstumsstörung. Weiterhin entwickeln wir derzeit genetische Mausmodelle, um durch die Inaktivierung verschiedener mTOR-Komponenten dessen Rolle während der frühen embryonalen Herzentwicklung zu verstehen.
Eine intrauterine Wachstumsretardierung kann beim Menschen unter anderem durch eine mütterliche Mangelernährung während der Schwangerschaft oder eine Funktionsstörung der Gebärmutter verursacht werden. Im Tiermodel führt z.B. eine Verminderung der Proteinmenge in der mütterlichen Nahrung zu einer fetalen Wachstumsretardierung, die durch ein hypoplastisches Herz aufgrund einer reduzierten Kardiomyozytenzahl bei der Geburt charakterisiert ist. Um die Bedeutung eines suffizienten Aminosäure-Stoffwechsels für die Entwicklung des embryonalen, fetalen und postnatalen Herzens zu verstehen, untersuchen wir die Konsequenzen einer Proteinreduktion während der Schwangerschaft in Ratten und Mäusen. Vorläufige Ergebnisse legen nahe, dass ein Aminosäuremangel in Mäusen keine Auswirkungen auf das Wachstum des embryonalen oder fetalen Herzens hat, sich aber in einer reduzierten Herzgröße im Erwachsenenalter äußert. Demnach wäre also eine suffiziente Proteinversorgung weniger für die Proliferation von pränatalen als viel mehr für die Hypertrophie von postnatalen Kardiomyozyten essentiell. In laufenden Projekten untersuchen wir daher die Bedeutung der Aminosäure-Verfügbarkeit auf das Umschalten von proliferativem zu hypertrophem Wachstum in der Perinatalphase.