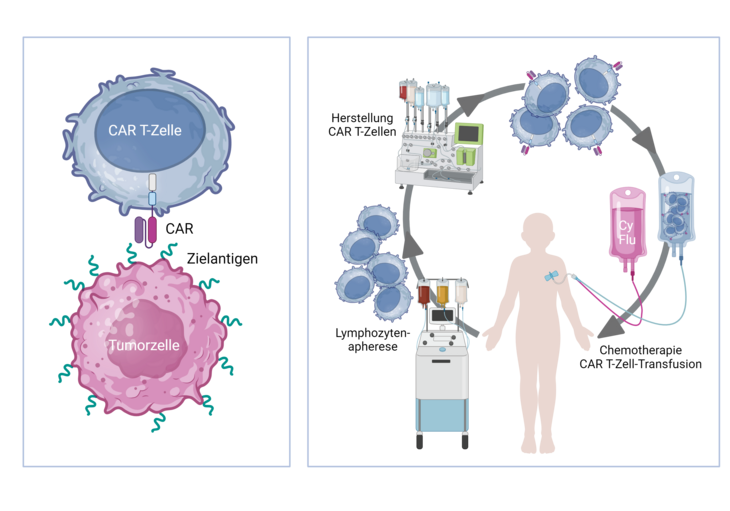
Ziel der Entwicklung von Immuntherapien gegen Krebs ist die gezielte Abstoßung bösartiger Zellen durch das Abwehrsystem des Patienten. Dies erfordert eine gezielte Beeinflussung des Abwehrsystems, das im Normalfall zwar erfolgreich Infektionen bekämpft, jedoch nicht oder nur unzureichend Krebszellen erkennt und vernichtet. Inhalt aktueller Forschungsprojekte der Arbeitsgruppe ist daher die Entwicklung hochwirksamer, spezialisierter Immunzellen, die Leukämie- und Tumorzellen erkennen und gezielt abtöten. So können T-Zellen des Patienten oder eines gesunden Spenders durch genetische Veränderung mit Rezeptoren ausgestattet werden, die eine Erkennung von Tumorzellen über Oberflächenmerkmale ermöglichen (Abb. 1). Diese Rezeptoren werden CARs genannt, „chimeric antigen receptors“. Die Resistenz von Tumoren gegenüber der Erkennung durch zytotoxische T-Zellen wird auf diese Weise primär umgangen. Die Arbeit unserer Gruppe konzentriert sich darauf, effektive Therapieverfahren mit CAR-modifizierten Abwehrzellen zu entwickeln und in klinische Anwendungen zu übersetzen.
Abb. 1: Links: Prinzip der CAR T-Zell-Therapie. T-Zellen werden durch Gentransfer mit CARs ausgestattet, über die sie Oberflächenantigene auf der Tumorzelle als fremd erkennen und die Zelle gezielt vernichten. Rechts: Ablauf der CAR T-Zell-Therapie. Aus Lymphozyten der Patientin/des Patienten werden in einem Herstellungsverfahren CAR T-Zellen generiert und nach einer vorbereitenden Chemotherapie über die Vene verabreicht. Image created with Biorender under academic license.