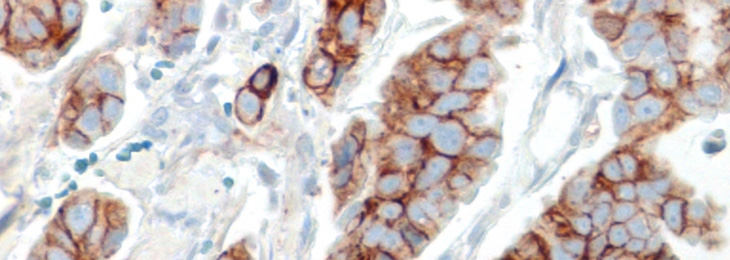
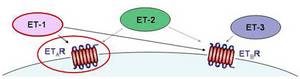
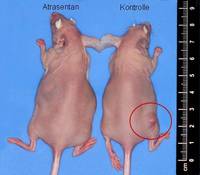
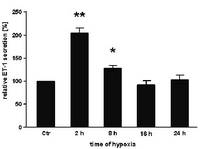
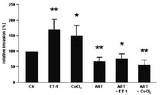
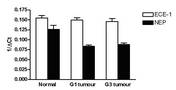
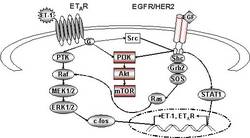
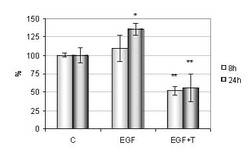
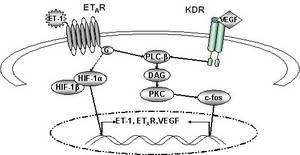
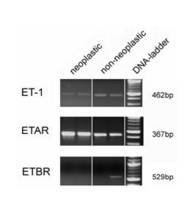
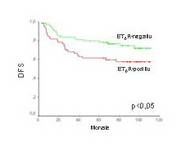
- beim Mammakarzinom die Überexpression von HIF-1α signifikant mit der ET-1-Expression korreliert
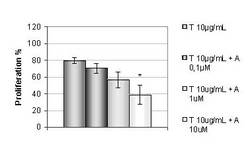
- Hypoxie die zelluläre Sekretion von ET-1 stimuliert und so indirekt die Invasivität der Brustkrebszellen steigert
- die Hypoxie-induzierte Invasion maßgeblich durch parakrine Effekte von ET-1 vermittelt wird.
Mitarbeiter: Dr. rer. nat. Martin Götte
Kooperationspartner: Dr. C. Kersting, Prof. Dr. H. Bürger (Gerhard-Domagk-Institut für Pathologie, UKM); Prof. Dr. C. Bremer (Institut für Radiologie, UKM); Dr. G. Hudelist, Prof. Dr. C. Singer (Universität Wien); PD Dr. C. Krusche (Universität Aachen) Das Mammakarzinom ist der häufigste maligne Tumor der Frau mit weltweit über einer Million Neuerkrankungen pro Jahr. In Deutschland erkrankt etwa jede zehnte Frau im Laufe ihres Lebens daran. Ferner stellt das Mammakarzinom in Deutschland die häufigste Krebstodesursache dar (41,9 je 100.000 Frauen; 17,1% tumorbedingte Mortalität). Da der Tumortod beim Mammakarzinom zumeist durch eine distante Metastasierung bedingt ist, gilt die adjuvante systemische Therapie (ergänzend zur Operation und Radiatio) derzeit als Therapiestandard. Ziel der adjuvanten systemischen Therapie ist dabei, vermutete Tumorreste und Mikrometastasen kurativ zu behandeln. Man versucht dabei, die Wahl der systemischen Therapie (zytotoxische Chemotherapie und/oder endokrine Therapie) dem individuellen Rezidiv- und Metastasierungsrisiko der jeweiligen Patientin anzupassen. Erschwert wird dies durch die große Heterogenität des Erkrankungsverlaufes des Mammakarzinoms und den Mangel an zuverlässigen Prognosefaktoren, so daß immer auch Patientinnen "unnötig" eine Chemotherapie erhalten, deren niedriges Risiko nicht erkannt wird. Insofern gilt das Interesse der (gynäko-) onkologischen Forschung derzeit u.a. der Identifizierung neuer valider Prognosefaktoren und der Erschließung alternativer, "zielgerichteter" und nebenwirkungsärmerer Therapiestrategien ("targeted therapies") des Mammakarzinoms.